小奕说药 | 一张图讲述下游纯化工艺表征
发布时间:2024-12-13 13:00分类: 无 浏览:154评论:0

根据FDA的工艺验证指南,工艺表征(Process Characterization,PC)设定为一个建立和获取工艺知识与理解的步骤,是工艺验证中非常重要的环节,也是产品通过注册获得上市许可的前提条件。根据药品质量管理体系(PQS),需要将对产品和工艺的增强理解,与质量风险管理结合起来,建立适当的控制策略(ICHQ10)。
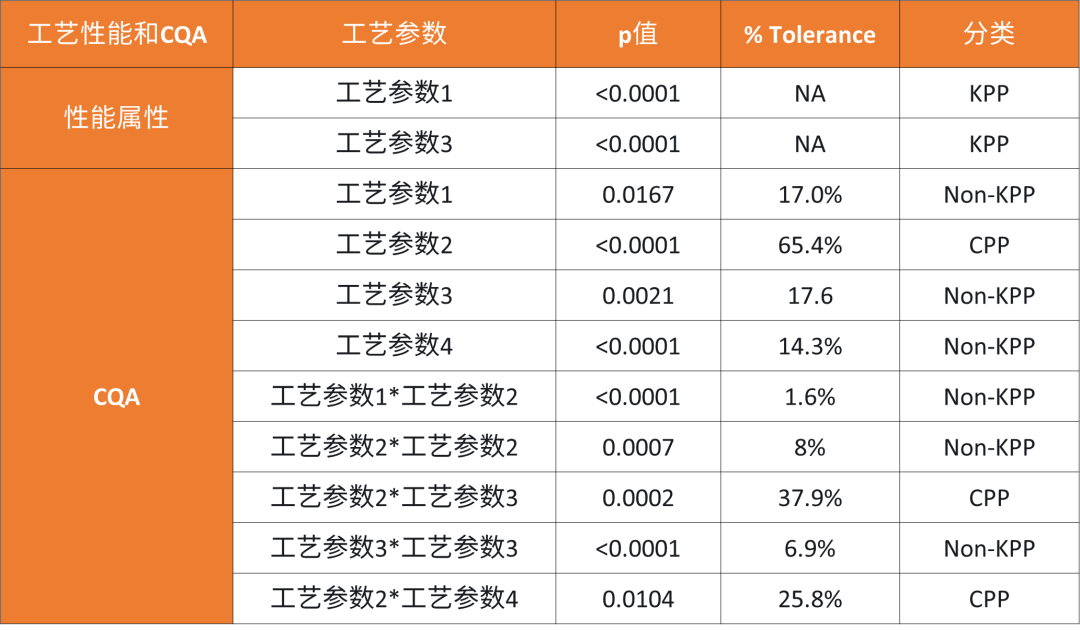
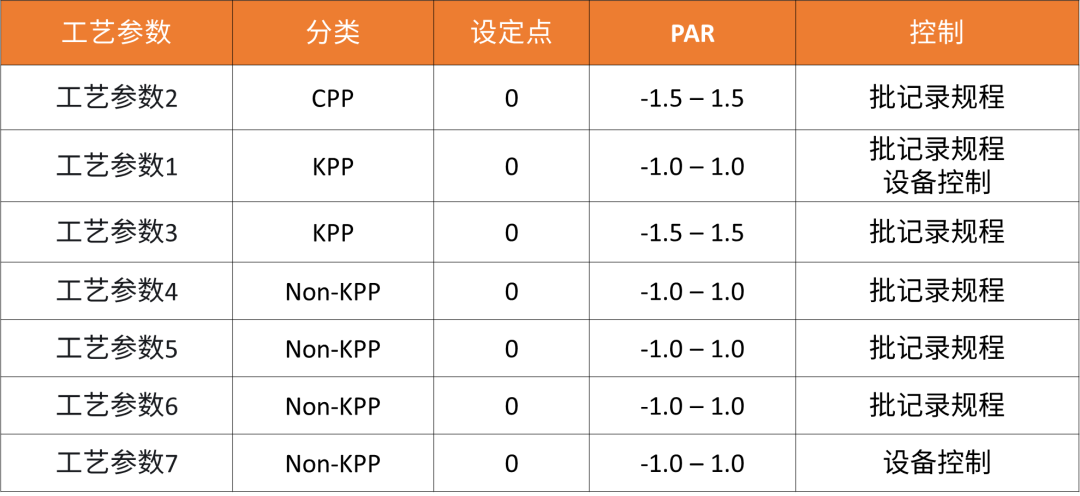
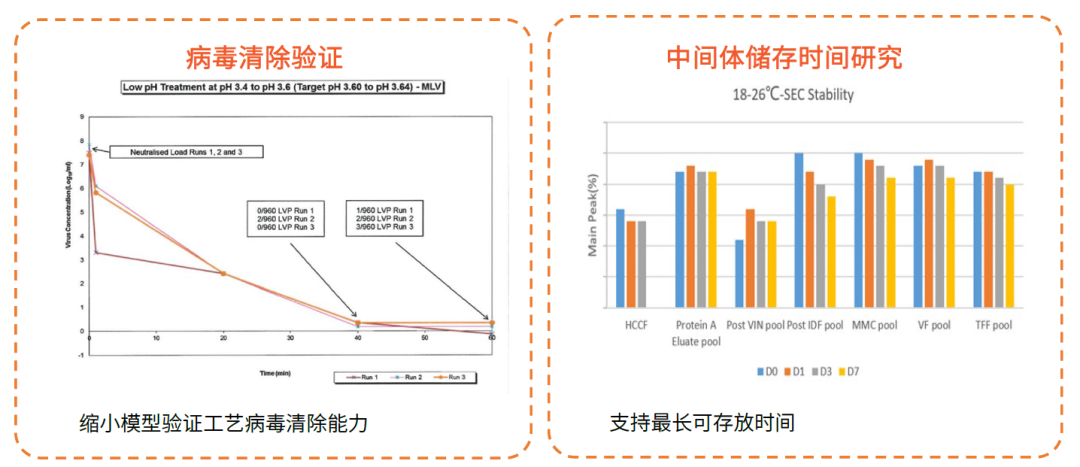
因此基于已有经验,评估风险,并通过实验获得更多产品和工艺理解,通过有目的性地改变操作参数以确定其对产品质量属性和工艺性能的影响,确保生产稳健性,提高产品质量是工艺表征的主要目标,也是向监管机构展示生产企业对生产工艺的理解和认知的重要步骤,工艺表征相关内容也是项目监管申报的CTD资料的3.2.S.2.6工艺验证/评价中需要体现的内容。
基于产品开发的QbD方法、法规理解、行业实践及生物工艺的可操作性,一个完整和成功的工艺表征研究需要整合和完成以下内容:
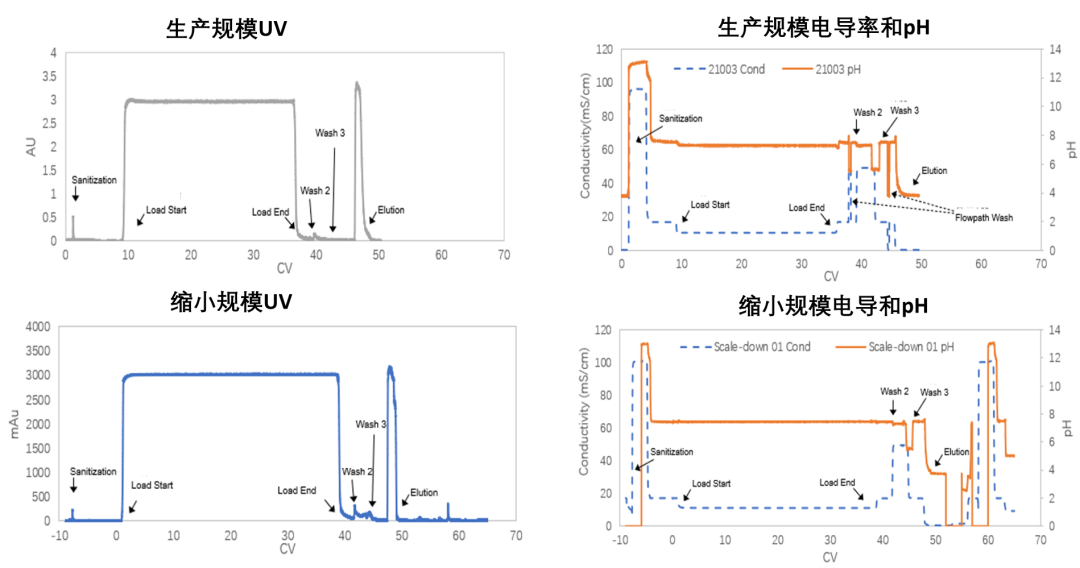
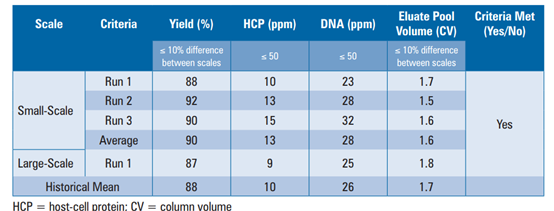
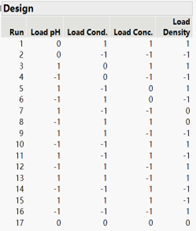
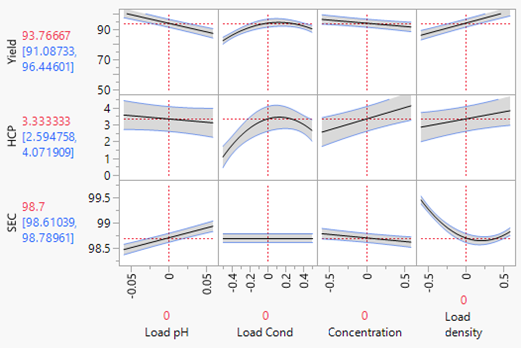
下游纯化工艺表征流程

结语
工艺表征的目的是建立和获取工艺知识与理解,需要使用风险评估、实验设计等工具,可以系统、完整的完成工艺表征研究,确保工艺过程提供符合质量标准的产品,并保证工艺的一致性和稳健性,为工艺验证和后续的注册申请打下基础。
参
考
文
献
[1] FDA Guidance for Industry: Process Validation: General Principles and Practices, 2011
[2] PDA Technical Report NO 60: Process Validation: A Lifecycle Approach, 2013
[3] CMC Biotech Working Group, A-Mab, a Case Study in Bioprocess Development. 2009
[4] NIIMBL, N-Mab, a Case Study to support development and adoption of integrated continuous bioprocesses for monoclonal antibodies. 2022
推荐阅读
关于奕安济世
About HJB
奕安济世具有丰富的细胞系开发、工艺开发、临床样品生产及放行、IND/BLA申报的全流程经验。奕安济世在杭州拥有工艺开发中心及符合cGMP标准的原液及成品生产车间,通过技术的不断创新及稳定的连续化生产工艺,可极大缩短工艺开发进程和降低生产成本,为生物药创新合作伙伴提供优质、可靠、快速的CDMO服务。
我们与客户共赢,我们与时代共进。
业务咨询:
CDMO@hjbbio.com | 13601691087 | 0571-2827 9502*8555