国自然热点!一文讲清T细胞耗竭的发生和结局
发布时间:2025-04-22 14:39分类: 无 浏览:71评论:0

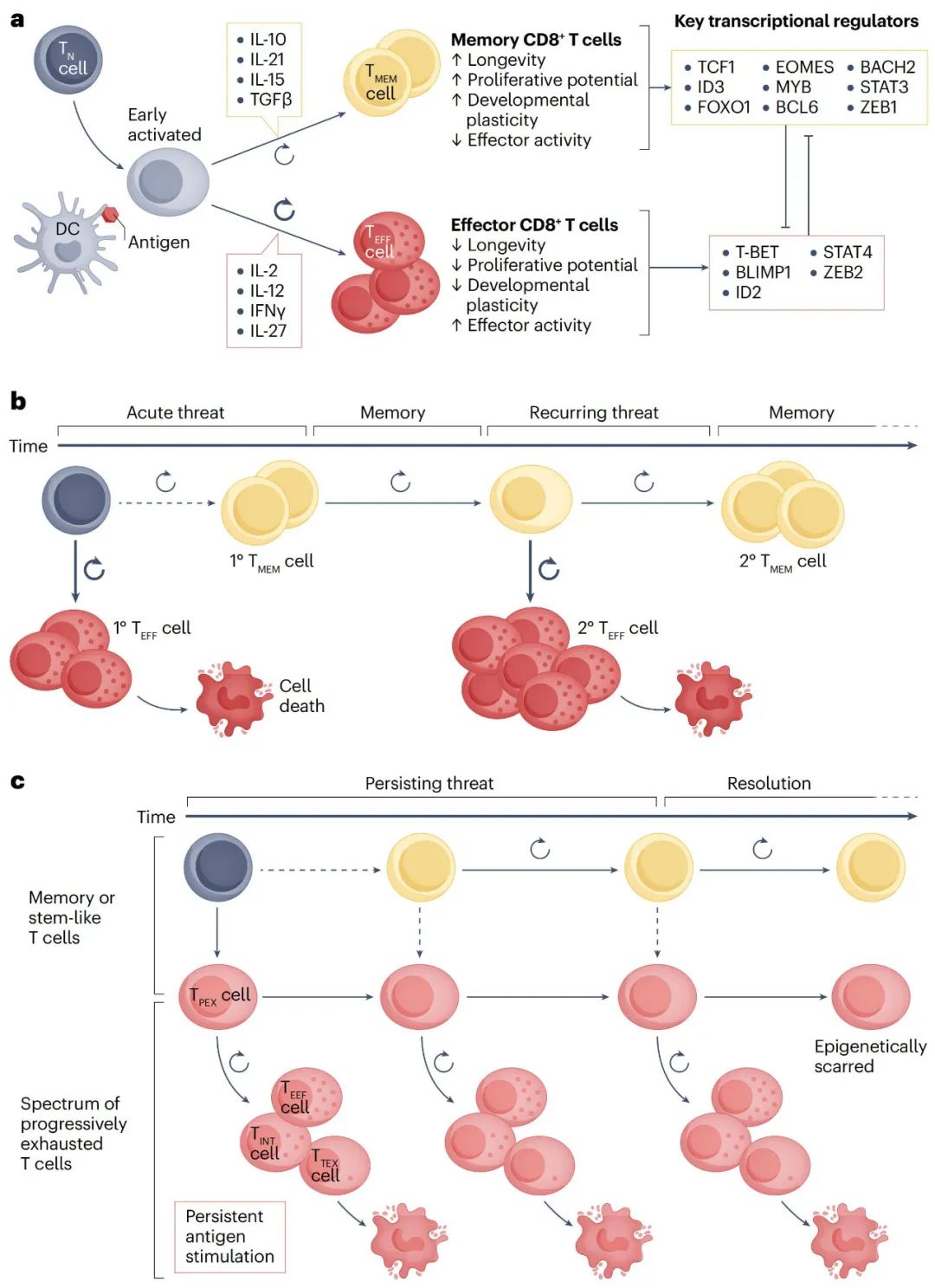
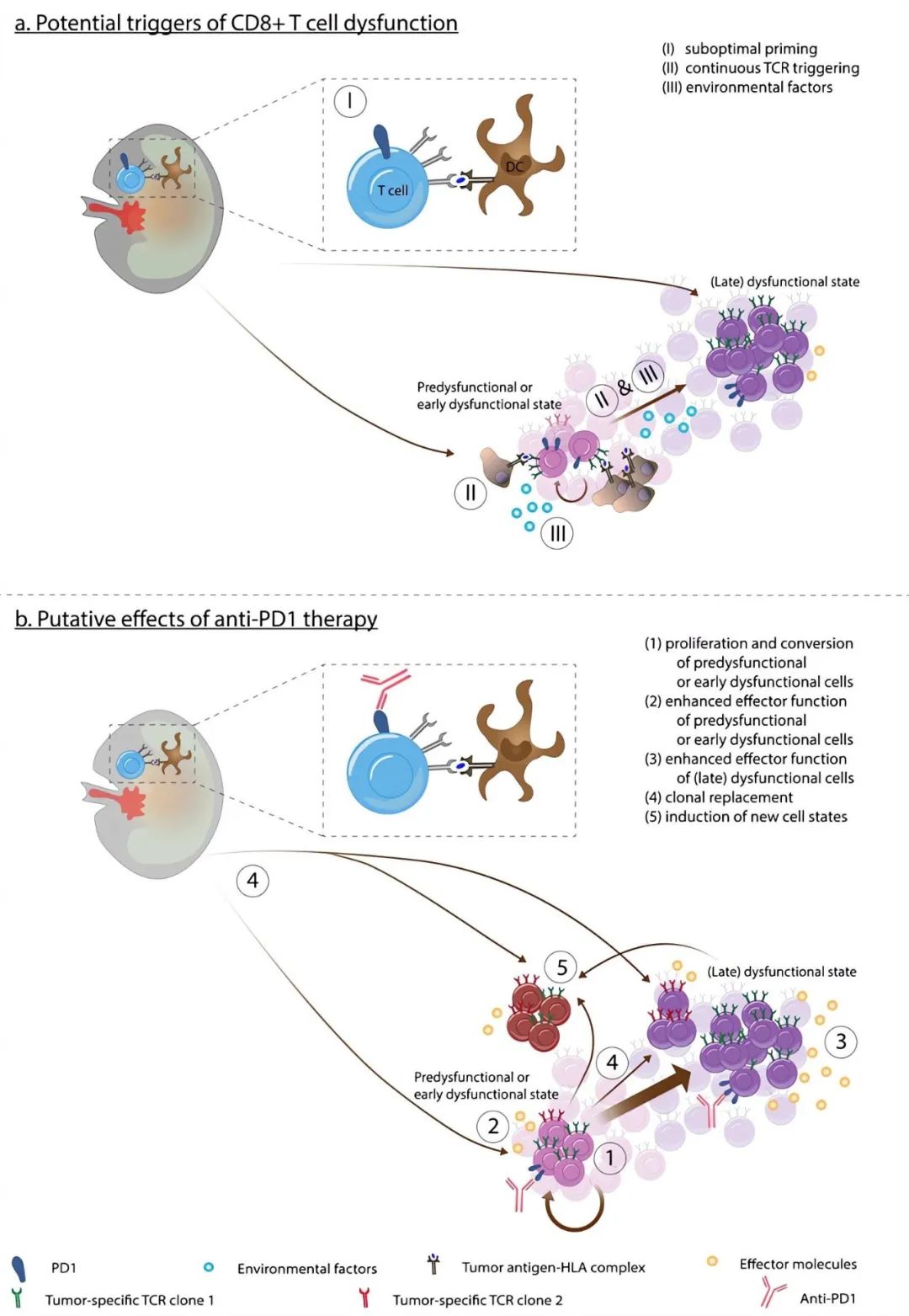
T细胞,特别是CD8+ T细胞,是免疫系统的关键部分,其功能状态直接影响免疫应答。激活后的T细胞会分化为短寿命效应细胞或具有干细胞特征和可塑性的长寿命细胞,比如干细胞样耗竭T细胞(TPEX细胞)和记忆T细胞。记忆T细胞通常在急性感染或肿瘤刺激后形成,能提供长期免疫记忆,让机体在未来遇到相同抗原时快速反应;而TPEX细胞是由持续抗原刺激下不完全分化的效应T细胞转化来的,保留了自我更新和发育潜力。
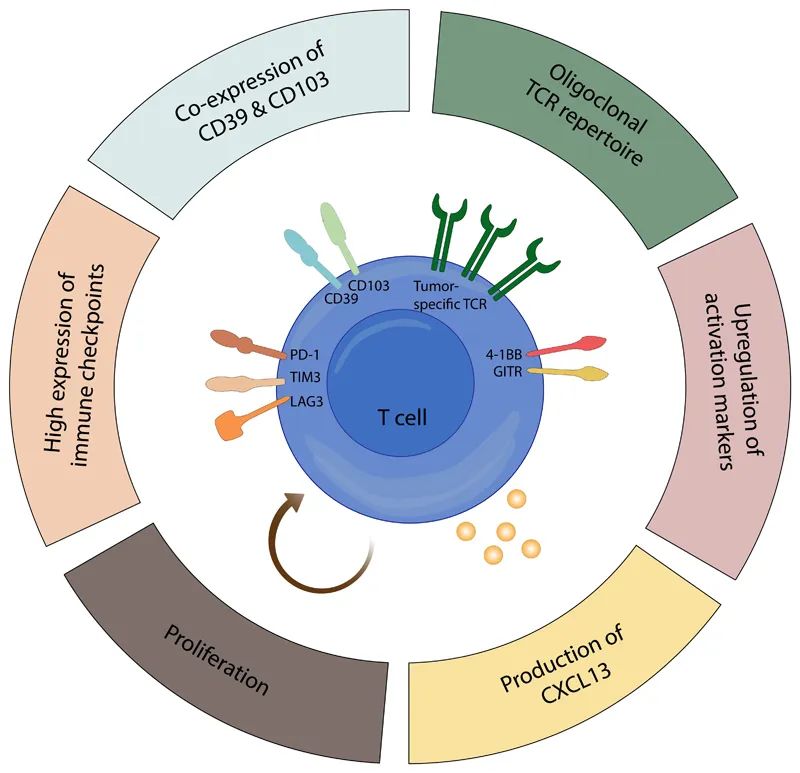
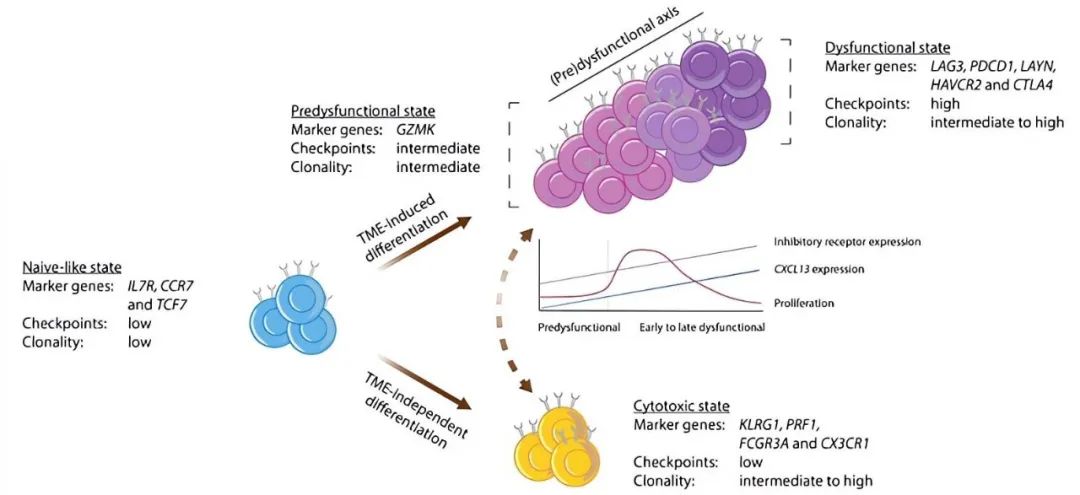
T细胞耗竭是一个复杂的过程,从具有干细胞样高增殖能力的前体耗竭T细胞到完全失去效应功能和增殖能力的终末耗竭T细胞,这一过程不仅是免疫系统功能调节的重要机制,也是肿瘤对免疫检查点抑制和过继性细胞转移治疗产生耐药性的主要途径之一。因此,深入了解T细胞耗竭的多维度特性,对开发新型免疫治疗策略意义重大。


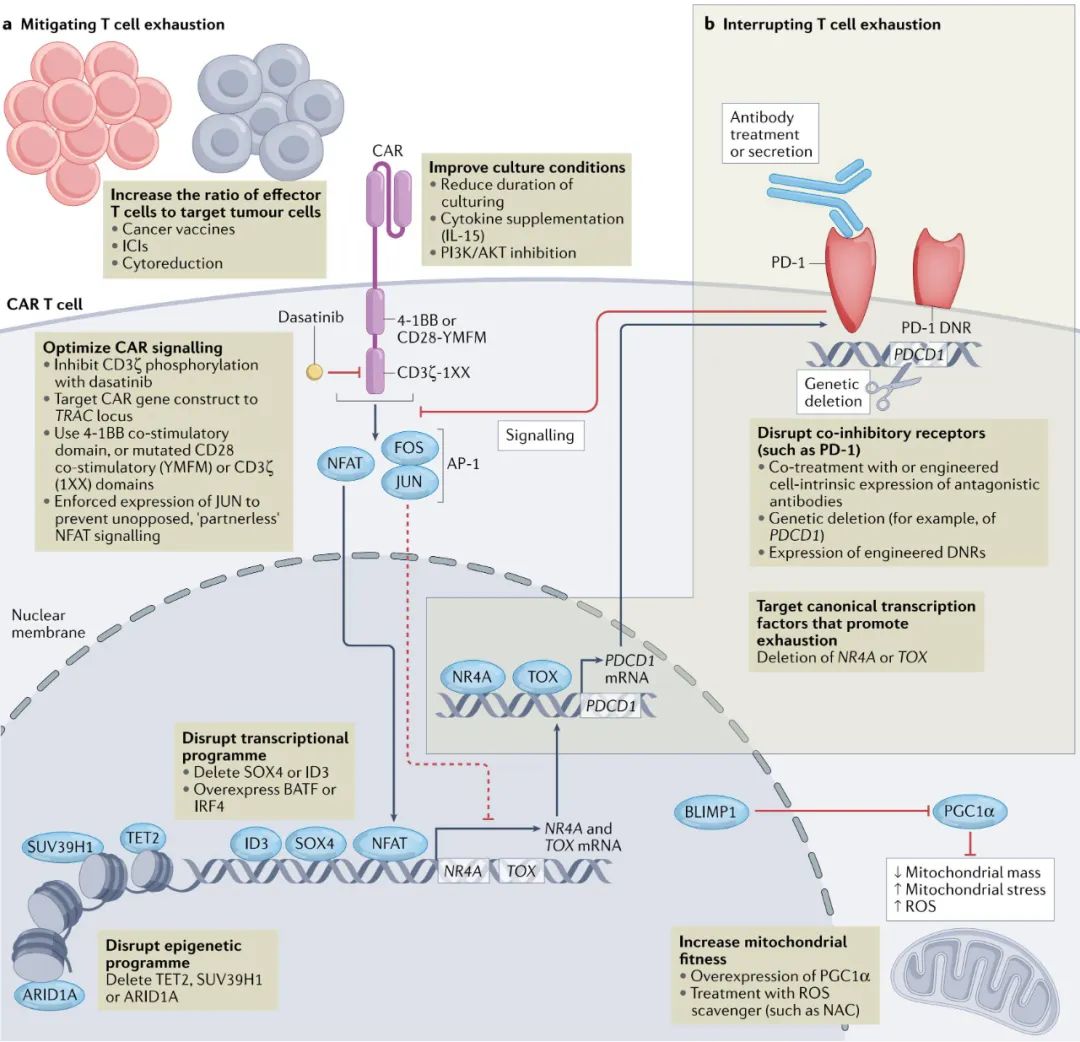
调整T细胞与肿瘤细胞的比例:通过减少肿瘤负荷或增加输注的CAR-T细胞数量来减轻T细胞耗竭。 优化培养条件:包括缩短培养时间、添加特定细胞因子以及使用PI3K/AKT抑制剂等手段。 优化CAR结构:设计低亲和力的嵌合抗原受体或T细胞受体,可以限制T细胞在体内的过度分化,进而减少终末衰竭的发生。 中断NFAT信号传导:T细胞功能与耗竭之间的平衡受到转录因子AP-1和NFAT的影响。持续的信号传导会导致NFAT信号失调,进而促进T细胞耗竭。 缓解代谢障碍:持续的T细胞刺激还伴随着线粒体功能障碍,增加了活性氧(ROS)的生成。利用N-乙酰半胱氨酸或烟酰胺清除ROS,有助于恢复T细胞的抗肿瘤效应。
VectorBuilder云舟生物是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“载体家”平台,开启了个性化基因载体的商品化时代;目前已赋能全球90多个国家和地区,为超过4500家顶尖科研院校和制药公司提供服务,在QS前100高校的客户覆盖率达到了90%,全球TOP30药企的客户覆盖率亦超过90%,产品成果的全球文献引用量逾5000篇。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。